Das Protein AP180 spielt eine subtile Rolle bei der Erregungsübertragung im Gehirn. Unter hoher Belastung sorgt es für das effiziente Recycling eines Vesikelproteins, was sich im Tierversuch in verblüffender Weise auf Verhaltensmuster auswirkt. Wie die Gruppen von Volker Haucke und Tanja Maritzen gezeigt haben, stellt AP180, das möglicherweise auch bei psychotischen bipolaren Störungen und bei Autismus eine Rolle spielt, eine Feinjustierung in unserem Nervensystem dar, um dessen enorme Leistungsfähigkeit und Flexibilität abzusichern.
Den Proteintransport an Synapsen kann man sich wie einen schnellen Expressbus vorstellen, findet Volker Haucke: Mit quietschenden Reifen stoppt ein gehetzter Fahrer an den Haltestellen, und wer mitkommen will, muss in den Wagen hechten, bevor die Fahrt weitergeht. Damit trotz des extremen Tempos nicht allzu viele Fahrgäste an den Haltestellen stranden, stehen fürsorgliche Helfer bereit und befördern mit raschem Griff die langsameren Passagiere in den Bus. Wie wichtig diese Helfer für das Wohlergehen des gesamten Organismus sind und wie sie sogar komplexe Verhaltensmuster beeinflussen, wurde nun durch zwei Arbeiten am FMP deutlich.
Im Fachmagazin Neuron stellen die Gruppen von Volker Haucke und Tanja Maritzen eine Knockout-Maus-Variante vor, der einer der Transporthelfer, das Protein AP180, fehlt. Die Nager sind dadurch nicht nur hyperaktiv und leiden an mitunter tödlichen epileptischen Anfällen, sie legen auch eine für Mäuse völlig untypische Waghalsigkeit an den Tag. Setzt man die Tiere in einem Verhaltenstest auf eine erhöhte Plattform mit abzweigenden Laufstegen, so erkunden die unveränderten Mäuse die Ausläufer nur, wenn sie von Wänden begrenzt werden. Die mutierten Mäuse aber entwickeln ohne AP180 wahren Todesmut: Sie verlassen die Hauptplattform und laufen auch ohne Wände, nahe am Abgrund, die abzweigenden Laufstege entlang.
Im Gegenzug scheint es den Draufgängern an häuslichen Qualitäten zu mangeln: Im Vergleich zu normalen Mäusen zeigen sie kaum Motivation zum Nestbau. Was geschieht dabei in den Nervenzellen? Auf den ersten Blick funktioniert die Übertragung elektrischer Signale an den Synapsen auch ohne AP180, doch bei genauerer Analyse zeigt es sich, dass die Kapazitäten bei einer höheren Signaldichte erlahmen. Dadurch werden besonders hemmende Nervenzellen beeinträchtigt, die häufig tonisch, also andauernd aktiv sind. Die Balance zwischen Gaspedal und Bremse im Gehirn gerät somit aus dem Gleichgewicht. Wie die Gruppen um Haucke und Maritzen in einer Vielzahl von Versuchen gezeigt haben, sorgt AP180 an den Synapsen für den flotten Transport des Vesikelproteins Synaptobrevin2 (Syb2).
Dieses ist eine der drei Komponenten des sogenannten SNARE-Proteinkomplexes, der bei eintreffenden Nervenimpulsen die Fusion von Vesikeln mit der Außenmembran bewirkt. Auf diese Weise schüttet die Nervenzelle Neurotransmitter in den synaptischen Spalt aus und leitet so das elektrische Signal weiter. Anschließend muss Syb2 im Höchsttempo von der Nervenzellmembran zurück ins Zellinnere geholt werden, wo es für erneute Vesikelfusionen gebraucht wird. Dafür stülpt sich die Zellmembran im Prozess der Endozytose nach innen und nimmt dabei Vesikelproteine mit. Das Adaptorprotein AP180, so konnten die Wissenschaftler zeigen, agiert hier wie ein Einstiegshelfer beim Expressbus. „Auch ohne AP180 wird Syb2 wieder ins Zellinnere transportiert, doch viel weniger effizient. Am Ende gelangen nur etwa halb so viele Syb2 Moleküle zurück auf die synaptischen Vesikel der hemmenden Nervenzellen wie normalerweise“, sagt Tanja Maritzen. Das Adaptorprotein, das Syb2 mit der Endozytose-Maschinerie der Zelle verknüpft, handelt dabei wie eine fürsorgliche Gouvernante, die auf bestimmte Passagiere spezialisiert ist.
Durch ihre Versuche hat die Forschergruppe ein bisheriges Paradoxon gelöst: Rein mechanisch genügt eigentlich eine Handvoll SNARE-Komplexe und damit eine handvoll Syb2-Proteine für den Fusionsprozess, doch jedes Vesikel enthält etwa 70 der Moleküle. „Theoretisch hätte deshalb die Hälfte der Syb2-Proteine immer noch völlig ausreichen müssen, doch wir konnten nachweisen, dass die Fusion im Organismus mit 70 Molekülen eben doch besser abläuft als mit 35“, sagt Volker Haucke.
Auch in einer zweiten, in Nature Communications veröffentlichten Arbeit, geht es um Syb2 und AP180, zugleich aber um eine allgemeinere Frage: Was geschieht mit Vesikelproteinen, nachdem die Vesikel auf einen Nervenimpuls hin ihre Botenstoffe ausgeschüttet haben? Die an der Fusion beteiligten Membranproteine treten keineswegs sofort die Rückreise an, sondern verbleiben zunächst in der Zellmembran. Würden sie hier völlig ungehindert diffundieren und so auseinander treiben, dann hätten sie bald den Bereich der Synapse verlassen, würden sich entlang der langen Nervenfortsätze verteilen und wären so für eine Wiederverwendung verloren.
Zwar kann man die Wanderung von Membranproteinen nicht ohne Weiteres beobachten, doch der Gruppe von Volker Haucke gelang dies mit Hilfe eines Tricks. Zunächst koppelten sie Syb2 an ein leuchtendes Protein, das nur bei einem bestimmten pH-Wert und damit nur in der Zellmembran aufleuchtet. Durch einen starken Laser knipsten sie dann sämtliche der dort schon vorhandenen Vesikelproteine aus und stimulierten die Nervenzelle für zwei Sekunden. Anschließend konnten sie anhand der neu auftretenden Lichtsignale die Ausbreitung der Syb2-Moleküle beobachten und so ihre Diffusion berechnen. Das Ergebnis: Die Vesikelproteine breiten sich in den ersten 4 Sekunden nach einem Nervenimpuls über die Synapse aus, dann stoßen sie auf eine Barriere von noch unbekannter Natur. Im Verlauf der folgenden 20 bis 40 Sekunden wird der größte Teil dann aber wieder auf ein kleineres Areal zurückbefördert. Dieses „Reclustering“ scheint von der Maschinerie der Endozytose getrieben zu sein, und auch hier kommt wieder AP180 ins Spiel. Fehlt den Nervenzellen das Adaptorprotein, dann diffundiert Syb2 über ein größeres Areal und wird nur schlechter wieder eingefangen. AP180 agiert also nicht nur als freundliche Gouvernante beim Einsteigen in den Expressbus der Endozytose – die Gouvernante scheint auch wie mit langen Gummiarmen in die weitere Umgebung greifen zu können, um gezielt ihre Schützlinge einzufangen, die nicht geduldig an der Haltestelle stehen, sondern in der näheren Umgebung flanieren.
Das Zusammenspiel von AP180 und Syb2 zeigt auf eindrucksvolle Weise, mit welch subtilen Mechanismen Nervenzellen ihre hohe Leistungsfähigkeit und Flexibilität absichern: AP180 ist für die Endozytose nicht absolut notwendig, doch es verbessert ihre Effizienz, was sich wiederum auf die innere Balance im Gehirn und auf Verhaltensweisen auswirkt, und damit letztlich das Überleben sichert. Schließlich versterben Mäuse, denen AP180 fehlt, im Mittel schon innerhalb der ersten Wochen nach ihrer Geburt, während ihre normalen Geschwister eine Lebenserwartung von mehreren Jahren haben. Nervenzellen müssen unter Umständen extrem rasch reagieren – bei Sinneswahrnehmungen feuern sie bis zu 1000 mal in einer Sekunde, bei anderen Prozessen wie etwa der Bildung von Erinnerungen vielleicht nur 10 mal. „Das System muss rasch reagieren, dabei aber unglaublich präzise und zuverlässig sein“, sagt Volker Haucke. „Schließlich sind Nervenzellen in der Regel unersetzlich — sie bilden unsere Erinnerungen und Identität ab und müssen über viele Jahrzehnte funktionieren.“ Beim Menschen gibt es Hinweise darauf, dass Veränderungen im Gen für AP180 bei der Entstehung psychotischer bipolarer Störung und bei Autismus eine Rolle spielen könnten. Das detaillierte Verständnis der Vorgänge an Synapsen könnte sich daher einmal als Schlüssel zum Verständnis neuronaler Erkrankungen erweisen.
Quellen:
Seong Joo Koo, Gaga Kochlamazashvili, Benjamin Rost, Dmytro Puchkov, Niclas Gimber, Martin Lehmann Georgi Tadeus, Jan Schmoranzer, Christian Rosenmund, Volker Haucke, Tanja Maritzen: Vesicular synaptobrevin/VAMP2 levels guarded by AP180 control efficient neurotransmission. Neuron, 88, Vorabveröffentlichung am 24. September 2015, dx.doi.org/10.1016/j.neuron.2015.08.034.
Niclas Gimber, Georgi Tadeus, Tanja Maritzen, Jan Schmoranzer, Volker Haucke: Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nature Communications 6, 8392, doi:10.1038/ncomms9392, veröffentlicht am 24. September 2015.
Bildunterschrift:
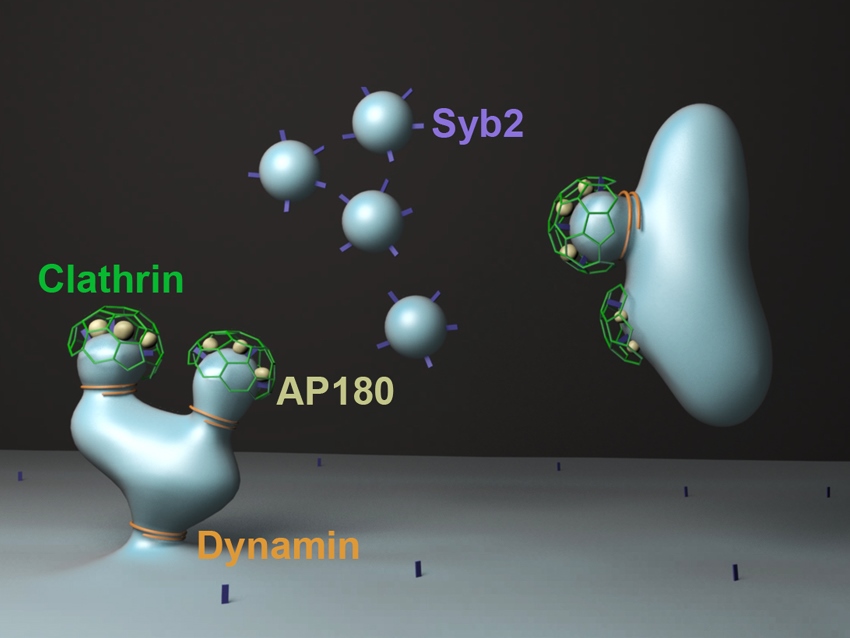
Das Adapter-Protein AP180 stellt sicher, dass Synaptobrevin2 (Syb2) in sich abschnürende von Clathrin umhüllte Vesikel sortiert wird. Es sorgt somit dafür, dass die daraus entstehenden synaptischen Vesikel genügend Syb2 enthalten, was eine wesentliche Voraussetzung für eine effiziente Erregungsweiterleitung im Gehirn ist.