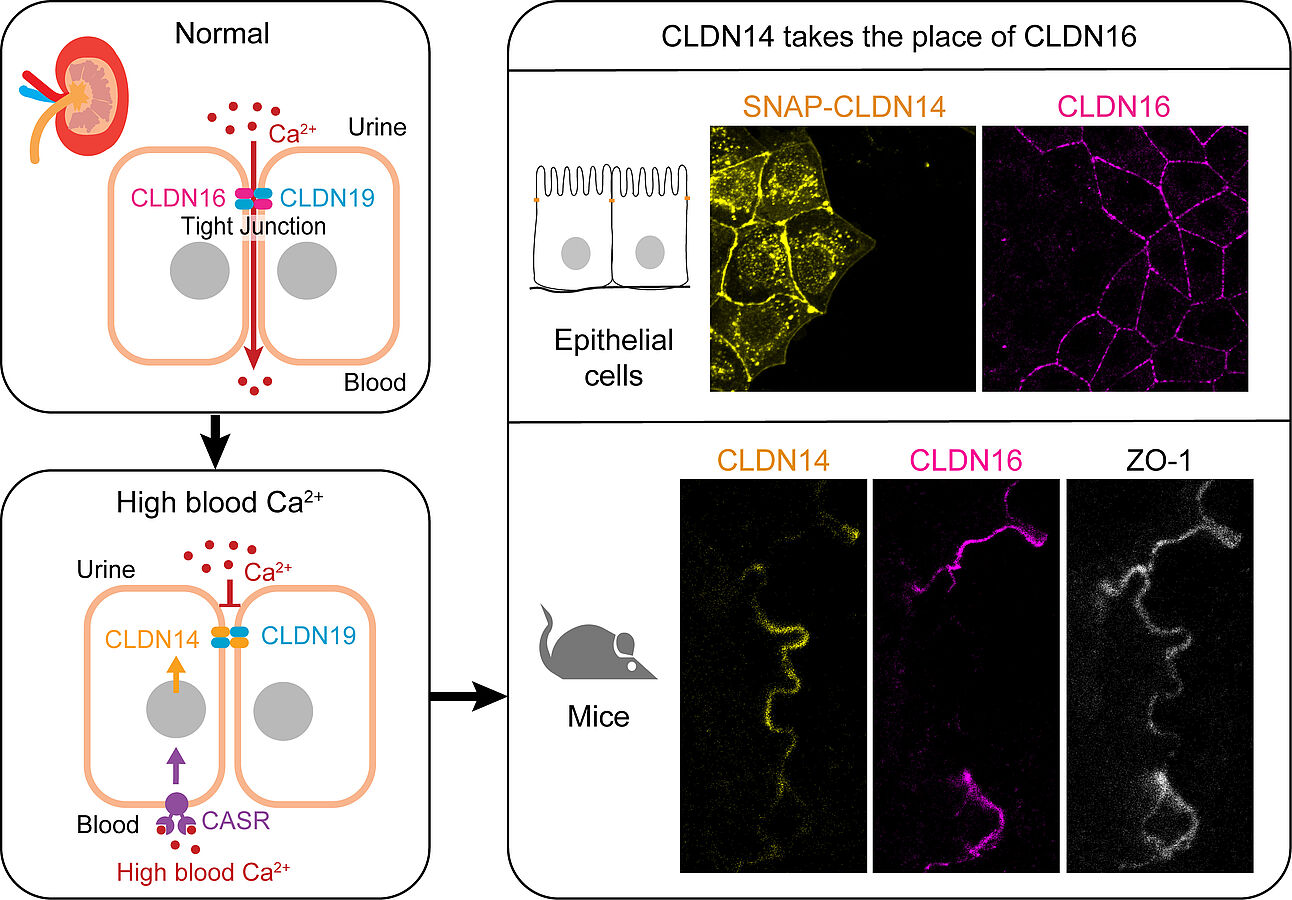
Dabei spielt das Claudin-14 Protein eine Schlüsselrolle: Es verdrängt das parazelluläre Transportprotein Claudin-16 in den sogenannten Tight Junctions der Niere und beeinflusst so maßgeblich den Calciumfluss. Die Ergebnisse wurden in der renommierten Fachzeitschrift PNAS veröffentlicht.
Der Körper ist auf eine stabile Calcium-Homöostase angewiesen, die wesentlich durch die Niere reguliert wird. Epithelzellen bilden enge Verbindungen, sogenannte Tight Junctions, welche den parazellulären Transport von Stoffen – also dem Transport zwischen den Zellen - kontrollieren. In einem speziellen Segment der Niere, dem „thick ascending limb“ (dicker, aufsteigender Ast) ermöglichen Kopolymere aus Claudin-Proteinen Claudin-16 und Claudin-19 den Rücktransport von Calcium aus dem Urin zurück ins Blut.
Erhöhte Calciumspiegel im Blut führen zur Aktvierung des Calciumsensor-Rezeptors, der wiederum die Expression von Claudin-14 erhöht. Claudin-14 stört die Calcium-Leitfähigkeit des Claudin-16/19 Kopolymers wodurch mehr Calcium über den Urin ausgeschieden wird. Dieser Mechanismus schützt vor zu hohen Calciumwerten im Körper. Gleichzeitig ist bekannt, dass genetische Varianten von Claudin-14 das Risiko für Nierensteinerkrankungen erhöhen können.
Forschende um Rozemarijn van der Veen, Marie Bieck, Nacéra Mezouar, Volker Haucke und Martin Lehmann vom Leibniz-FMP sowie Henrik Dimke von der Universität in Süd-Dänemark in Odense nutzten modernste Mikroskopieverfahren, darunter die hochauflösende STED-Mikroskopie, sowie Zell- und Mausmodelle, um die dynamische Umgestaltung der Tight Junctions sichtbar zu machen und zu erforschen. Sie zeigen erstmals, dass Claudin-14 bevorzugt mit Claudin-19 Polymerstrukturen bildet und so den Platz von Claudin-16 über einen Zeitraum von mehreren Tagen einnimmt.
Damit konnten die Forschenden einen neuen Mechanismus aufzeigen, wie sich die Zusammensetzung der Claudin-Proteine in den Tight Junctions flexibel anpasst, wodurch die Nieren-Calcium-Ausscheidung reguliert wird.
Diese Erkenntnisse liefern wertvolle molekulare Einblicke in die Regulation der Calcium-Homöostase der Niere und eröffnen neue therapeutische Perspektiven zur Behandlung von Nierensteinleiden und Störungen des Calciumstoffwechsels.