Die Protonenhydratation spielt eine zentrale Rolle in den Transportmechanismen der Energiekonversion in Brennstoffzellen und der Signalübertragung durch Transmembranproteine in lebenden Organismen. Allerdings wird die wässrige Solvatation überschüssiger Protonen in Lösung intensiv diskutiert, weil sie als komplexe, stark mit ihrer Umgebung wechselwirkenden Quantenobjekte schwer zu untersuchen sind. Ein Konsortium aus Forscherteams des Max-Born-Instituts, der Universität Hamburg, der Universität Stockholm, der Ben-Gurion-Universität des Negev und der Universität Uppsala hat nun wichtige Erkenntnisse über die elektronische Struktur hydratisierter Protonenkomplexe in Lösung gewonnen, die über die traditionellen Eigen- oder Zundel-Bilder hinausgehen. Bei Letzteren bilden vier bzw. zwei Wassermoleküle den hydratisierten Protonenkomplex. Im Gegensatz dazu haben die Forscher durch den Einsatz modernster Flüssigkeitsflachstrahl-Technologie zur Messung der Sauerstoff-Röntgenspektren an der Synchrotronstrahlungsquelle BESSY-II entdeckt, dass die elektronische Struktur der drei innersten Wassermoleküle in einem H7O3+-Komplex durch das Proton drastisch verändert wird und darüber hinaus die erste Hydrathülle aus fünf weiteren Wassermolekülen um diesen inneren H7O3+-Komplex das Protons über sein langreichweitiges elektrisches Feld wahrnimmt.
Schulbücher der Chemie lehren uns, dass es in wässriger Lösung keine reinen Protonen gibt, da die Affinität von flüssigem Wasser für Protonen außerordentlich hoch ist. Am bekanntesten ist das Oxonium-Ion H3O+, bei dem sich ein Proton mit einem Wassermolekül zu einer eigenständigen Spezies verbindet. In der Mitte des 20. Jahrhunderts wurden zwei größere hydratisierte Protonenkomplexe mit charakteristischen, wohldefinierten Strukturen postuliert, einer von Manfred Eigen und der andere von Georg Zundel. Als Anerkennung für ihre bahnbrechenden Arbeiten wurden die Ionen nach ihnen benannt: Das Eigen-Kation H9O4+ besteht aus einem zentralen Oxonium-Ion, das über Wasserstoffbrücken zu drei Wassermolekülen den Komplex H3O+( H2O)3 bildet. Das Zundel-Kation H5O2+ besteht aus einem Proton, das sich zwei stark gebundene Wassermoleküle teilen und so das Motiv H2O···H+···OH2 bilden. Nach heutiger Auffassung stellen das Eigen- und das Zundel-Ion Grenzstrukturen des hydratisierten Protons in flüssigem Wasser dar, wobei die tatsächliche Struktur von protoniertem Wasser noch immer umstritten ist.
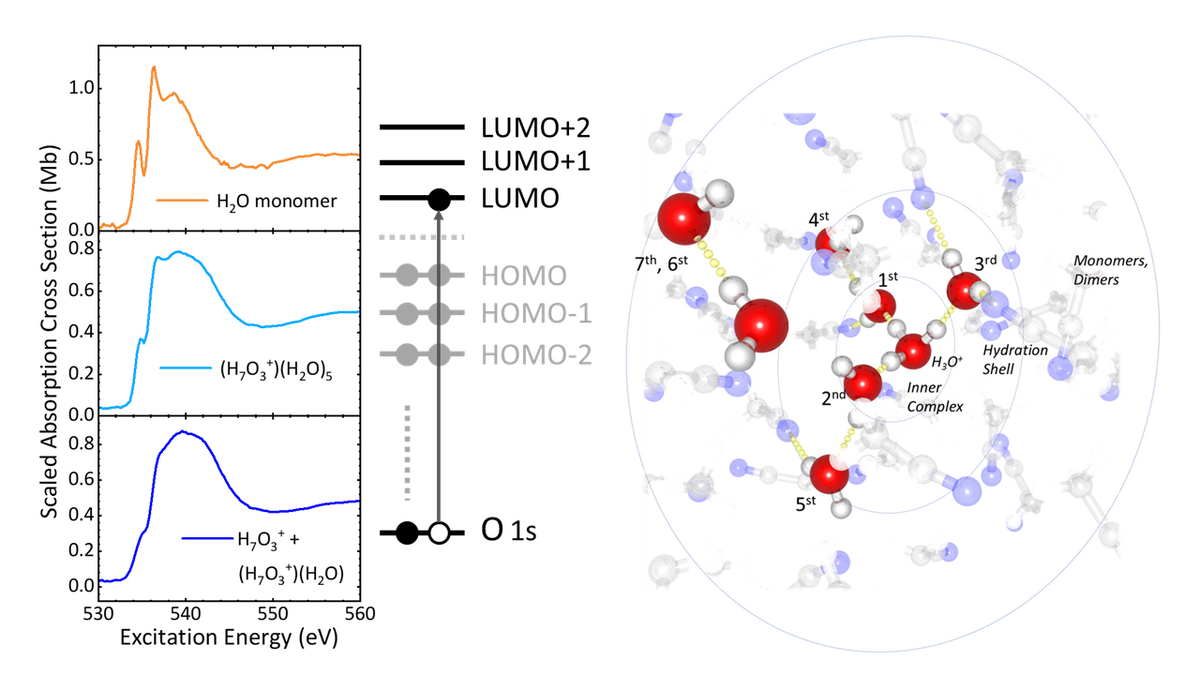
Bislang war die elektronische Struktur hydratisierter Protonenkomplexe in Lösungen bei Raumtemperatur schwer fassbar, obwohl die elektronische Struktur wichtige Informationen über alle Wassermoleküle liefern würde, die direkt von der Anwesenheit eines Protons betroffen sind. Ein solches elektronisches Strukturbild sollte deutlich über die beiden begrenzten Eigen- und Zundel-Geometrien hinausgehen. Idealerweise hätte man eine lokale Sonde der elektronischen Ladungsdichten in den Wassermolekülen, die unmittelbar an der Hydratation des Protons beteiligt sind. Durch die Bildung von Wasserstoffbrückenbindungen unterschiedlicher Stärke dürfte sich die elektronische Struktur dieser mit dem Proton direkt interagierenden Wassermolekülen tiefgreifend ändern.
Die Ergebnisse, die an in Acetonitril gelösten Säure-Wasser-Gemischen erzielt wurden, legen eine allgemeine Hierarchie für die Protonenhydratation nahe: Das Proton interagiert mit drei Wassermolekülen und bildet einen H7O3+-Komplex. Die Hydratschale dieses Komplexes wird durch das elektrische Feld der positiven Ladung des Protons beeinflusst wird. Diese Schlussfolgerungen lassen sich aus dem Fehlen einer ausgeprägten Vorkante und einer starken Nachkante im Sauerstoff-Röntgenspektrum von H7O3+ ziehen, da Wassermoleküle eine deutliche Vorkante und eine viel kleinere Nachkante aufweisen. Die neuen Forschungserkenntnisse haben direkte Auswirkungen auf das Verständnis der Protonenhydratation von Protonen in wässriger Lösung über Protonenkomplexe in Brennstoffzellen bis hin zur Wasserstruktur Hydratationstaschen von Protonenkanälen in Transmembranproteinen. Die technologischen Forstschritte in der Spektroskopie mit weichen Röntgenstrahlen ebnen den Weg für weitere Entwicklungen in der stationären und ultraschnellen Röntgenspektroskopie, um die elektronische Struktur von Protonenkomplexen zu untersuchen und zu verstehen, wie elementare Schritte des Protonentransports die elektronischen Ladungsdichten in diesen Komplexen beeinflussen.